实验四 凝固点下降法测定摩 尔质量
一.实验目的
2.掌握溶液凝固点的测定技术。
3. 通过实验加深对稀溶液依数性的理解。
二.实验原理
1.凝固点降低法测分子量的原理
当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质 量摩尔浓度成正比。即
&nb sp; ΔT=Tf* - Tf = Kf bB (1)
式中,Tf*为纯溶剂的凝固点,Tf为溶液的凝固点, bB为溶液中溶质B的质量摩尔浓度,Kf为溶剂的质量摩尔凝固点降低常数,它的 数值仅与溶剂的性质有关。
若称取一定量的溶质mB(g)和溶剂mA (g),配成稀溶液,则此溶液的质量摩 尔浓度为
&nb sp; bB =1000mB/MB.mA,
式中,MB为溶质的分子量。将该式代入(1)式,整理得:
&nb sp; MB = 1000 Kf mB /ΔT. mA (g/mol) (2)
若已知某溶剂的凝固点降低常数Kf值,通过实验测定此溶液的凝固点降低值ΔT,即 可 计算溶质的分子量MB。
2.凝固点测量原理
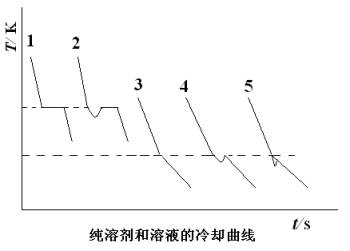
通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶 体,往往成为过冷溶液。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升 ,当放热与散热达到平衡时,温度不再改变。此固液两相共存的平衡温度即为溶液的凝固点。但过冷太厉 害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固 ,就得不到正确的凝固点。溶剂与溶液的冷却曲线形状不同。对纯溶剂两相共存时,冷却曲线出现水平线 段,其形状如图(1)所示。对溶液两相共存时,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度 回升,但回升到最高点又开始下降,所以冷却曲线不出现水平线段,而斜率发生变化,如图(2)所示。 由于溶剂析出后,剩余溶液浓度变大,显然回升的最高温度不是原浓度溶液的凝固点,严格的做法应作冷 却曲线,并按图(2)中所示方法加以校正。但如果溶液过冷程度不大,析出固体溶剂的量很少,对原始 溶液浓度影响不大,则以过冷回升的最高温度作为溶液的凝固点。
溶剂与溶液的冷却曲线
三.实验装置
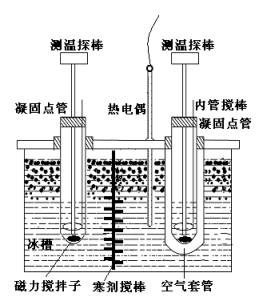
1-测温探棒;2-内管搅棒;3-投料支管; 4-凝固点管;5-空气套管;
6-寒剂搅棒;7-冰槽; 8-温度计。
四. 仪器及试剂:
仪器:凝固点测定仪、电子温差仪、电子分析天平、25mL移液管、洗耳球、滤纸、毛巾
试剂:环已烷、萘、冰块
五.实验步骤
1. 凝固点测定仪的设置
2. 调节寒剂的温度
取适量冰与水混合,使寒剂温度控制在3—3.5℃左右,在实验过程中不断搅拌 并不断补充碎冰,使寒剂保持此温度。
3.溶剂凝固点的测定
用移液管向清洁、干燥的凝固点管内加入25mL环已烷,并记下环已烷的温度。
先将盛环已烷的凝固点管直接插入寒剂中,平稳搅拌使之冷却,当开始有晶体 析出时放在空气套管中冷却,观察样品管的降温过程,当温度达到最低点后,又开始回升,回升到最高点 后又开始下降。记录最高及最低点温度,此最高点温度即为环已烷的近似凝固点。
取出凝固点管,用手捂住管壁片刻,同时不断搅拌,使管中固体全部熔化,将 凝固点管直接插入寒剂中使之冷却至比近似凝固点略高0.5℃时,将凝固点管放在空气套管中,缓慢搅拌 ,使温度逐渐降低,当温度降至比近似凝固点低0.2℃时,快速搅拌,待温度回升后,再改为缓慢搅拌。 直到温度回升到稳定为止,记录最高及最低点温度,重复测定三次,三次平均值作为纯环已烷的凝固点。
4.溶液凝固点的测定
取出凝固点管,如前将管中环已烷溶化,用分析天平精确称取萘(约0.15g)加入凝固点管中,待全部 溶解后,测定溶液的凝固点。测定方法与环已烷的相同,先测近似的凝固点,再精确测定,重复三次,取 平均值。
5.实验完成后,洗净样品管,关闭电源,弃取冰水浴中的冷却水,擦干搅拌器,整理实验台。
六.实验数据记录与处理
1.将实验数据列入表中。
记录时间: 1 次/ 秒 寒剂的温度:
室温: 大气压力: Pa
|
物质 |
体积/
质量 |
凝固点Tf |
凝固点降低值 |
萘的分子量 |
|
测量值 |
平均值 |
|
环已烷 |
|
1 |
|
|
ΔT= Tf* - Tf
= |
MB = 1000 Kf mB /ΔT. mA
= |
|
|
2 |
|
|
|
3 |
|
|
萘 |
|
1 |
|
|
|
|
2 |
|
|
|
3 |
|
2.由所得数据计算萘的分子量,并计算与理论值的相对误差。
七.注意事项
1.搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点 时搅拌条件要完全一致。准确读取温度也是实验的关键所在,应读准至小数点后第三位。
2.寒剂温度对实验结果也有很大影响,过高会导致冷却太慢,过低则测不出正确的凝固点。
3. 在测量过程中,析出的固体越少越好,以减少溶液浓度的变化,才能准确测定溶液的凝固点。若 过冷太甚,溶剂凝固越多,溶液的浓度变化太大,使测量值偏低。在过程中可通过加速搅拌、控制过冷温 度,加入晶种等控制过冷。







