实验十 乙酸乙酯皂化反应速率常数的测定
一、实验目的
1、用电导法测定乙酸乙酯皂化反应速率常数及活化能。
2、了解二级反应的特点。
3、了解电导率仪的构造,掌握其使用方法。
二、实验原理
乙酸乙酯皂化反应方程式为:
CH3COOCH2CH3 + OH- == CH3COO- + CH3CH2OH
在其反应过程中,反应物NaOH和生成物CH3COONa都为强电解质,能够通过测量电导率的方法测量其反应前后的浓度的变化,从而通过二级反应方程:
推导出反应速率常数与电导率的关系:
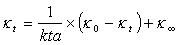
以
κt对(
κ0-
κt)/t作图可得一直线,其斜率等于1/(k•a)。由此可求得反应速率常数k。
三、实验仪器
电导率仪DDS-307或电导率仪DDS-11A,大口瓶 5000ml,容量瓶2000ml,针筒50ml,25ml 单标线移液管,双管反应池,烧杯100ml,洗耳球50ml,十字夹,电导电极,分析天平,氢氧化钠(分析纯),乙酸乙酯(分析纯),大张滤纸。
四、实验步骤:
1、利用恒温槽控制反应温度(复习恒温槽的操作方法)
2、采用称重法配制0.1000 mol/L的NaOH和乙酸乙酯反应液。
3、调节电导率仪,配制0.0500 mol/L的NaOH,测量反应初始的电导率值。
4、反应步骤
用移液管取25 ml NaOH标准溶液置于1池中,再取25 ml乙酸乙酯溶液置于2池中,将电导电极插入1池,2池上塞好橡皮塞。置于恒温槽中恒温10 min后,迅速用针筒混合反应液同时开始计时。继续混合两池中的溶液,约来回抽二、三次,每隔半分钟记录一次电导率数据。反应约20min即可停止实验。
5、实验完毕,清洗玻璃仪器,关闭电源,整理实验台,烘干所需玻璃仪器。
五、数据处理:
1、实验记录
以后每隔0.5分钟记录一次不同反应时间的电导率值,作出如下的数据表:
例表 在不同反应时间的电导率值
|
时间(min) |
0.5 |
1 |
1.5 |
2 |
2.5 |
3 |
3.5 |
4 |
4.5 |
5 |
5.5 |
6 |
6.5 |
7 |
|
κt(mS·cm-1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(κ0-κt)/t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
时间(min) |
7.5 |
8 |
8.5 |
9 |
9.5 |
10 |
10.5 |
11 |
11.5 |
12 |
12.5 |
13 |
13.5 |
14 |
|
κt(mS·cm-1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(κ0-κt)/t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2、对(κ0-κt)/t作图。
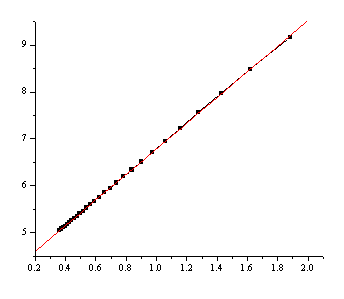
图 κt 对(κ0-κt)/t 的关系图
Y = A + B × X
Parameter Value Error
------------------------------------------------------------
A 4.05773 0.0033
B 2.73154 0.00388
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.99997 0.00813 28 <0 .0001
------------------------------------------------------------
3、由所得直线斜率(上表中的B)求反应速率常数k。
4、改变反应温度重复实验,测出不同温度下的反应速率常数k,利用阿仑尼乌斯方程求出反应的活化能(本实验略)。
六、注意事项
1、所用实验仪器均需干燥。
2、将反应液加入电导池过程中不要振动,否则容易引起液体的流动而预先混合。
3、初次混合时,应控制用力的力度,在速度快的同时,注意不要将反应液吸入针筒或喷出。
4、装入乙酸乙酸的反应管应用带乳胶管的塞子塞紧,但另一支装入NaOH的反应管应用带电导电极的橡皮塞轻轻盖住,不能塞得很紧。







